非HLA免疫遗传因素与非血缘供者造血干细胞移植
尽管HLA配型是供者选择和决定造血干细胞移植疗效的主要因素,但随着HLA检测技术的提高,即使在HLA全相合的allo-HSCT中仍有一定比例的患者发生GVHD。随着人类基因组计划的完成以及后基因时代的到来,对GVHD发生发展的分子遗传学研究日益增多。目前发现供受者次要组织相容性抗原、细胞因子基因及天然免疫相关基因等的多态性与GVHD发生风险和移植后非复发死亡密切相关,为研究GVHD的发病机制、探索GVHD的预防措施提供了新的线索。
(一)次要组织相容性抗原(minor histocompatibility antigens,mHags)
1.mHags的形成原理
mHags是相对于主要组织相容性抗原而命名。mHags由非MHC基因编码,由于其编码基因在种群内存在某些等位基因的单核苷酸多态性(SNP)致使编码的同源蛋白的氨基酸不同。第一个在分子水平鉴定的mHags——HA-1是由KIAA0203基因编码。由于其序列存在两个等位基因的多态性,因此其编码的HA-1的九肽分子在第3位氨基酸上表现为精氨酸(VLRDDLLEA,HA-1R)与组氨酸(VLHDDLLEA,HA-1H)的差异。这些蛋白经加工处理成为多肽与MHC结合表达于受者抗原递呈细胞表面,被供者T细胞作为外源物质所识别,而这些多肽即mHags。mHags主要包括两类:一类是由Y染色体基因编码的mHAgs,这类与性别相关的mHAgs被称为H-Y抗原;另一类是由常染色体基因编码的mHAgs。
2.mHags的组织分布
mHags的表达包括局限性表达和广泛性表达。在目前发现的30余种mHags中,HA-3、HA-8、UGT2B17、ACC-4、ACC-5及H-Y在各种细胞表面均有表达;HA-1、HA-2、ACC1、ACC2、LRH-1、CTL-7A7、RDR173、DNR-7、LB-ADIR-1、ACC-6仅局限性地在造血细胞起源细胞(包括白血病及其前体细胞)表面表达,在上皮起源的成纤维细胞、角质形成细胞、黑素细胞以及内皮细胞等表面不表达。另外,还有分布于单一造血细胞系的mHAgs,如HB-1是淋巴细胞系特异性表达的mHAgs,其表达局限于B细胞型急性淋巴细胞白血病(B-ALL)和EB病毒转化的B细胞表面。
3.mHags与造血干细胞移植
1990年,研究者首次报道了mHags与allo-HSCT的关系:在一位女性再生障碍性贫血患者接受HLA全相合男性同胞供者骨髓移植后植入失败的病例中,研究证实患者来源的T细胞能够通过识别一种特异性表达于男性细胞的抗原而溶解供者血细胞,此类抗原即H-Y抗原。当患者接受性别不匹配的供者时,免疫反应可以直接针对Y染色体上基因编码的H-Y抗原,因此发生GVHD的风险较高。在allo-HSCT中,mHags的组织分布决定了其免疫效应的方向和强度:表达广泛的mHags(如H-Y)同时参与GVHD和GVL效应;在非造血细胞上选择性表达的mHags(如CD31)可诱导GVHD,但不诱导GVL效应;在造血细胞上选择性表达的mHags(如HA-1、HA-2)可诱导GVL效应,但不产生或仅产生轻度GVHD;局限于单一造血细胞系的mHags(如HB-1)可诱导GVL效应,但不产生GVHD。此外,GVHD的发生是由宿主细胞表面mHags的密度和供者能识别mHags的T细胞受体共同决定。临床重度GVHD的发生要求供者T细胞识别多种不相合的受者mHags并发生免疫反应,单一mHags的不相合不能导致发生重度GVHD。
应用合成HA-1/HA-2多肽诱导产生HA-1/HA-2特异性细胞毒性T细胞(CTL),体外研究发现其对白血病细胞(ALL/AML)有选择性杀伤作用,对GVHD的靶细胞如成纤维细胞、内皮细胞和肝细胞等均无细胞毒作用。将体外诱导的HA-1/HA-2特异性CTL输入白血病小鼠,可发挥强大的GVL效应。局限表达于造血细胞起源细胞(如HA-1、HA-2)或单一造血细胞系的mHags分子(如HB-1)可在体内诱导产生特异性CTL,对白血病或淋巴瘤细胞发挥细胞毒作用,但对非造血细胞无此作用。这一策略在增强GVL效应的同时不增加GVHD风险,实现GVL效应与GVHD的分离。
尽管mHags在GVL效应与GVHD的分离研究中具有广泛的应用前景,但迄今为止,尚不能确定人类有多少个mHags。据推测,小鼠可能有大于700个mHags基因,而人类的基因数将更多,庞大的mHags基因信息将成为移植免疫的难题之一。另一方面,由于mHags的表达具有HLA限制性,而基于mHags的免疫治疗要求移植供受者之间HLA相合且特定的mHags不相合,因此目前可作为免疫治疗靶抗原而广泛应用于临床移植治疗的mHags数量极为有限。目前mHags相关的数据库已建立,而进一步发现新的局限性表达的mHags将是今后研究与应用的关键。随着临床试验的推进,基于mHags的免疫治疗,如mHags特异性T细胞输注、mHags疫苗,有望成为造血干细胞移植后复发白血病治疗的新方法。
(二)细胞因子基因多态性
急性GVHD的组织损伤是由供者T细胞识别宿主细胞表面抗原,介导细胞毒作用引起。其中大量炎性细胞因子参与了GVHD的发生和发展,即“细胞因子风暴学说”。由于遗传基因的多态性,不同个体内细胞因子的表达高低不同。细胞因子基因上游区内,特别是启动子/增强子区内DNA序列的不同,即使是一个核苷酸的突变、插入或丢失都可能显著改变转录因子的结合能力和(或)结合方式,从而影响基因转录,最终表现为细胞因子水平的差异。近年研究发现,异基因移植供者和(或)受者肿瘤坏死因子α(TNF-α)、白细胞介素(IL) -10、IL-6、γ干扰素(IFN-γ)、IL-1家族和转化生长因子β(TGF-β)基因的SNP与GVHD的发生有重要的关系。
表 供/受者细胞因子基因多态性与GVHD的关系
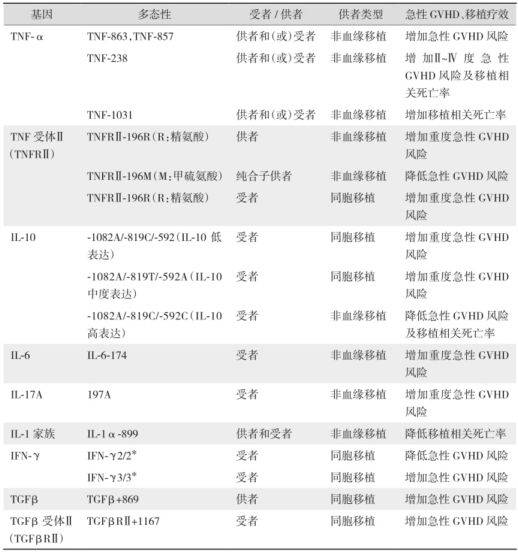
注:*IFN-γ等位基因2:IFN-γ第一个内含子具有(CA)n微卫星序列的多态性,人群中最常见的两个等位基因是(CA)12——等位基因2,(CA)13——等位基因3
目前国内外不同移植中心对细胞因子基因多态性与移植并发症、移植疗效的研究报道存在不一致性,可能与种群差异、样本数量、预处理方案、移植方式、GVHD预防方案等不均一性有关。进一步在大样本移植患者中研究细胞因子多态性与移植的关系,对预测移植风险、优化供者选择、制定个体化的免疫预防和治疗方案具有重要意义。
(三)天然免疫及感染相关基因与造血干细胞移植
机体的天然免疫最初被认为是一种通过巨噬细胞非特异性吞噬入侵病原微生物的反应,最近越来越多的研究证实天然免疫能特异性识别“自我”和“非我”,可能通过宿主组织/细胞表面的病原微生物识别受体(pathogen recognition receptors,PRR),如Toll样受体(toll-like receptors,TLR)、NOD样受体(nucleotide-binding oligomerisation domain containing receptors)识别病原微生物表面特异分子,激活抗原递呈细胞进而启动免疫反应。PRR在GVHD的发生、感染等移植并发症中的作用日益受到关注,其中NOD2/CARD15是近年来研究的热点。NOD2/CARD15主要在胃肠道免疫系统针对细菌细胞壁的反应中激活核转录因子κ B(NF-κ B),参与胃肠道的抗感染免疫反应。最近研究发现,NOD2/CARD15基因的三个单核苷酸位点(8,12,13)的变异在HLA相合非血缘供者和同胞供者移植中均与aGVHD的发生风险及严重程度密切相关,当供者和(或)受者具有NOD2/CARD15基因单核苷酸位点突变时,受者重度aGVHD的发生风险和TRM均显著增加。其他天然免疫及感染相关基因,如TLR基因、髓过氧化物酶(MPO)基因、甘露糖结合凝集素(MBL)基因、Fcγ受体基因等的单核苷酸多态性均发现与感染、移植相关死亡等并发症相关。
随着allo-HSCT移植相关基因研究的深入和基因检测技术的进步,分析整条染色体上成千上万个基因位点及其变异已成为可能。利用先进的分子生物学实验技术检测并筛选与GVHD等移植并发症的发生相关的分子遗传学因素,将对进一步指导合适供者的选择具有重要意义,但不同分子遗传学因素对移植结果的影响仍需进一步在大样本供者/受者的临床研究中证实。

