肠道微生态与胆汁酸代谢
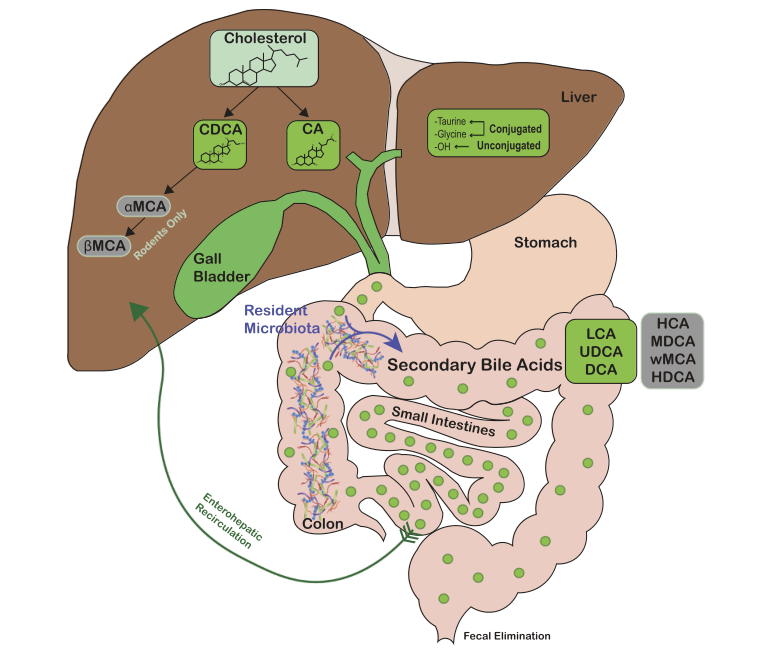
肠道菌群是目前热门的研究领域,其参与多种人体代谢并与多种疾病存在密切关联。肠道菌群参与构成肠道微生态,是人体健康的重要保障;胆汁酸是人体消化道中扮演着重要角色,其参与脂质和脂溶性维生素的代谢和吸收,故有肠道“清洁剂”之称。胆汁酸由肝细胞内的胆固醇转化而来,通过胆道系统进入小肠,辅助参与食物消化后大多数胆汁酸重吸收回到肝脏,少部分随粪便排出体外,称为胆汁酸的“肠肝循环”。近年研究发现肠道菌群与胆汁酸有着密切联系,一方面,肠道菌群可通过产生多种酶,如胆盐水解酶和7α脱羟基酶,影响胆汁酸代谢和胆酸池的成分;另一方面,组成胆酸池的多种胆汁酸,有的可以直接抑制菌群的活性,有的通过调节肠道屏障功能来间接影响肠道菌群的分布或生长,参与肠道微生态的组成,促进免疫系统的平衡、机体内环境的平衡和阻止肠道致病菌的入侵等作用。下面我们从肠道菌群对胆汁酸代谢的影响和胆汁酸对菌群的调控两个方面探讨肠道微生态与胆汁酸的相互作用。
一 菌群对胆汁酸的影响
微生物对胆汁酸的代谢作用是菌群参与宿主代谢过程的一个重要表现。肠道菌群可以通过合成胆盐水解酶,将结合型胆汁酸去共轭化分解成为游离胆汁酸和牛磺酸、甘氨酸等小分子物质。肠道定植梭菌还可通过7α脱羟基酶等作用,将未重吸收的初级胆汁酸通过脱羟基化、氧化和差异构象化等过程转化为次级胆汁酸。动物实验已证实菌群对胆汁酸代谢有着不可替代的作用。
1.菌群与胆盐水解酶
菌群通过胆盐水解酶将结合胆汁酸去共轭化产生游离胆汁酸,降低胆汁酸对菌群自身的毒性作用,并利用分解产生的牛磺酸和甘氨酸作为能量来源和代谢合成底物。菌群将甘氨酸分解生成氨和二氧化碳,为自身提供能量;牛磺酸可促进厌氧环境中梭菌生长,并分解产生亚硫酸盐促进胆盐降解。体外小鼠实验证实,添加益生菌的小鼠粪便中胆盐水解酶和游离型胆汁酸含量增加,从而促进粪便中胆汁酸的排泄,表明菌群可以通过胆盐水解酶调节胆汁酸的代谢。
2.菌群与7α脱羟基途径
结肠中定植的梭菌通过7α脱羟基酶途径催化初级胆汁酸生成次级胆汁酸,该途径中有3个关键酶,分别由梭菌的baiA2、baiB和baiE基因序列编码。baiB编码胆汁酸辅酶A链接酶,细菌摄取初级胆汁酸进入胞内后,催化胆汁酸硫酯化;baiA2基因编码胆汁酸3α羟基类固醇脱氢酶,与烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)结合后促进谷氨酸残基与共因子口袋结构中的结合位点结合,催化胆汁酸辅酶A酯化;baiE基因编码该途径的限速酶胆汁酸7α脱水酶,通过构象改变(α螺旋和β折叠)形成环状结构,在口袋结构中将多个氨基酸残基在盐桥相互作用下替换,最终形成次级胆汁酸。研究表明对小鼠添加胆汁酸饮食后,大便中产生胆汁酸7α脱羟基酶的梭菌水平明显增多,证实了部分菌群可调节肠道内胆汁酸代谢。
3.菌群与固醇类物质
胆汁酸同其他类固醇物质可作为信号分子参与机体内分泌调节。定植梭菌(Clostridium scindens)具有“生化醇”特性,通过编码17,20-固醇碳链分解酶参与胆固醇激素代谢,将糖皮质激素转化为肾上腺素。睾酮类物质可以促进梭菌7α脱羟基酶的活性,进一步反馈影响胆汁酸和固醇类物质代谢。目前菌群与生化固醇和胆汁酸的代谢之间是否存在反馈通路仍尚未明确。
二 胆汁酸对菌群的影响
1.胆汁酸调节菌群的结构
胆汁酸对肠道菌群的构成和丰度有着重要影响,既可以通过直接杀伤作用减少定植菌数量,也可以通过内分泌功能,促进肠腔内其他细胞分泌抑菌物质,上调宿主黏膜免疫,间接控制肠道菌群的稳定性,进而影响肠道内菌群的组成结构。
胆汁酸对菌群的直接作用:研究表明,极低浓度的胆汁酸即可改变细胞膜中脂质的含量,随着浓度的升高,胆汁酸可溶解细胞膜,导致膜蛋白分离,消除跨膜电位,增加细胞通透性及改变磷脂、糖脂的比例,从而使细胞内物质泄漏,当胆汁酸进入菌内时,类似于清洁剂的作用,改变胞内大分子结构和功能,破坏DNA,激活DNA修复酶。通过胆汁酸的选择作用,机体内共生定植菌群产生外排泵、改变细胞膜脂质和蛋白的组成等多种机制,抵抗或者耐受胆汁酸,而外来入侵菌由于缺少对胆汁酸毒性的耐受而被直接杀死。部分定植菌(例如C.scindens和C.hiranonas)可通过产生羟化类固醇脱氢酶等将胆汁酸中鹅脱氧胆酸转化成亲水性更高的熊脱氧胆酸,降低胆汁酸对于菌群的毒性。也有研究提示定植菌可以通过产生去胆酸差向异构酶降低胆汁酸的毒性。
胆汁酸通过调节肠黏膜屏障功能作用于菌群:胆汁酸通过激活肠黏膜免疫屏障功能,对菌群定植和过度繁殖产生限制。研究发现胆汁酸具有内分泌功能,作为体内信号分子的一种,通过核受体(包括法尼醇X受体、维生素D受体、孕激素受体等)及G蛋白耦联浆膜受体(如膜胆酸受体TGR5、M样受体、1-磷酸鞘氨醇受体2),诱导肠上皮细胞编码产生抗菌肽和凝集素类似物,改变肠道的通透性等,维持肠道屏障功能,进而影响肠道内菌群微环境。人结肠组织中二羟基胆汁酸增加可改变肠道屏障功能和通透性,进而导致肠腔内大肠埃希菌移位。对比正常喂养小鼠,鹅脱氧胆酸喂养小鼠模型中通过非法尼醇X受体途径诱导肠黏膜细胞的Muc2表达,从而改变小肠黏膜免疫细胞组成,证实了胆汁酸可通过信号通路影响肠黏膜屏障功能,造成菌群发生变化。
2.胆汁酸可以调节艰难梭菌在消化道中的定植
艰难梭菌作为院内感染的重要病原,目前受到越来越多的重视。正常情况下健康人体肠道菌群具有自我稳定、自我调节的功能,艰难梭菌感染常常发生于大量广谱抗生素使用后,肠道微生态平衡受到破坏。研究发现不同胆汁酸成分对艰难梭菌定植生长有不同的影响。正常肠内定植的梭菌产生次级胆汁酸可抑制艰难梭菌在消化道中的定植,梭菌可以将胆酸转化为脱氧胆酸,有效的抑制艰难梭菌在动物模型和人类患者结肠中的定植。对于复发性艰难梭菌感染患者给予粪菌移植治疗,对比治疗前后患者粪便中胆汁酸对艰难梭菌芽孢的作用发现,患者移植前大便中胆汁酸对艰难梭菌并无抑制作用,而移植后则具有较高的抑制作用,可间接证明定植菌群通过胆汁酸的代谢,稳定肠道菌群、抑制艰难梭菌增殖。体外实验发现鹅脱氧胆酸和鼠胆酸通过竞争抑制牛磺胆酸作用,抑制艰难梭菌芽孢萌发。
综上所述,肠道菌群和胆汁酸之间存在一个复杂的代谢网络:一方面胆汁酸可以通过抗菌肽或凝集素类似物,对肠道内细菌产生抑制作用,从而限制菌落过度繁殖,并调节肠道菌群的数量、种类的稳定;另一方面定植于肠道的大多菌群通过编码表达酶,将结合胆汁酸去共轭化为游离胆汁酸、初级胆汁酸转化为次级胆汁酸,改变胆汁酸池的成分和浓度,降低胆汁酸对菌落毒性,提高菌落耐受,同时调节胆汁酸及氨基酸的代谢。胆汁酸对菌群既有抑制菌落过度繁殖和有害菌定植的作用,也依赖共生菌的代谢来协助消化;而菌群受胆汁酸的影响,改变自身结构,调节胆汁酸池的成分来影响其他致病菌如艰难梭菌的定植。肠道菌群和胆汁酸之间的稳态平衡,共同影响整个机体的代谢过程。

